ИНТЕРЕСНОЕ В ХИМИИ
Интересное в химии.
ИНТЕРЕСНОЕ О ГАЗАХ.
Веселящий газ
Американский химик Джеймс Вудхауз в 1800 году изучал взаимодействие серы с нагретым раствором нитрита натрия NaNO2 в формамиде HCONH2. Внезапно началась бурная реакция с выделением газа со слабым приятным запахом. Вудхаузу вдруг стало весело, и он пустился в пляс. распевая песни. На другой день, вернувшись в лабораторию, он обнаружил в колбе, где шёл опыт, кристаллы тиосульфата Na2S2O3. Почти в то самое время английский химик Гемфри Дэви проводил термическое разложение нитрата аммония NH4NO3. Как потом он вспоминал, помошник слишком близко наклонился к установке и нгесколько раз вдохнул газ с приятным запахом, выходивший из реторты. Вдруг помощник разразился беспричинным смехом, а потом свалился в углу комнаты и тутже заснул.
Учёные получили один и тот же газ -оксид азота (I) N2O. Вентхауз получил по реакции:
2S+2NaNO2=N2O+Na2S2O3,
а Дэви использовал термическое разложение NH4NO3:
NH4NO3=N2O+2H2O
Открытый многократно кислород
С этим газом химики знакомы с давних пор, но его природу долго установить не удавалось. Предположтельно, что впервые этот газ получил голландский алхимик Корнелиус Дреббел в 1602 г. нагреванием селитры. В 1615 г. Дреббел первое подводное судно, наполнил его газом, в котором мог спокойно дышать, и вместе с командой из 12 человек погрузился на три часа на дно Темзы близ Лондона. В этой экспедиции участвовал и король Англии Джеймс (Яков I). Позднее, в 1678.,датский учёный Оле Борх, а в 1721г. священник Стивен Гейлс повторил опыт Дреббела. В 1772 году шведский аптекарь Карл Шееле выделил тот же газ реакцией "чёрной магнезии" ( MnO2) с серной кислотой и назвал его "райским воздухом". Этим газом был кислород.
Дреббел получил его разложением нитрата калия:
А Шееле получил кислород действием серной кислоты на диоксид марганца:
2MnO2+2H2SO4=2MnSO4+H2O+O2
Испорченный газ
В 1772 году три химика-Карл Шееле, Генри Кавендиш,Даниель Резерфорд независимо друг от друга поставили один и тот же опыт, Они пропускали воздух через раскалённый уголь, а потом через водный раствор щёлочи-гидроксида натрия. Оставшуюся непоглащённую часть воздуха они собрали в сосуды и отметили, что в нём гасли горящие лучины. Химики посчитали, что раскалённый уголь испортил воздух, и назвали газ "удушливым воздухом", "ядовитым воздухом". Вы, наверное, догадались , что этим газом был углекислый газ.
Рудничный газ
В 1812 году на одной из английской шахт взрывом рудничного оаза за несколько секунд было убито более 100 шахтёров, а сотни получили тяжёлые травмы. Власти обратились к известному имику Гемфри Дэви. После многочисленных опытов, от которых у Дэви и его помощника Майкла Фарадея лица и руки покрылись ссадинами, было предложено защищать пламя горняцких ламп металлической сеткой.Для чего это делалось? Рудничный газ-это метан СН4. Метан проникает вместе с воздухом через металлическую сетку к пламени горняцкой лампы, взрывается и тушит пламя, но через сетку взрыв не передаётся наружу, так как продукты взрыва охлаждаются и воспламенение метана за пределами лампы становится невозможным.
Негорючий газ
В 1903 году в американском штате Канзас из нефтяной скважины внезапно забил фонтан газа. К великому изумлению нефтяников, газ оказался негорючим. Новая встреча с ним пришлась на годыПервой мировой войны. В немецкий дирижабль , сбрасывающий бомбы на лондон, попал зажигательный снаряд, н дирижабль не вспыхнул. Медленно истекая газом, он улетел прочь. Секретные службы Англии переполошились: до этого немецкие дирижабли взрывались от попадания снарядов. так как были наполнены водородом. Эксперты-химики вспомнили, что задолго до войны немецкие пароходы зачем-то везли в качестве балласта монацитовый песок из Индии и Бразилии. Этим газом был гелий. В монацитовом песке, который долгое время являлся главным гелийсодержащим сырьём, содержится радиоактивный элемент торий, при распаде которогообразуется гелий, который по плотности уступает только водороду, но имеет перед водородом преимущество: он негорюч и химически инертен.
ИНТЕРЕСНОЕ ИЗ ИСТОРИИ МЕТАЛЛОВ.
Небесно-голубой цезий
В 1860 году немецкие учёные химик Роберт Бунзен и физик Густав Кирхгоф обнаружили в спектре соединений нового элемента-металла две небесно-голубые линии. По цвету спектральных линий и получил название этот химический элемент-цезий. На самом деле этот металл с голубыми линиями в спектре в свободном состоянии имеет золотисто-жёлтый цвет. Он легко плавится: достаточно подержать запаянную ампулу с этим металлом в ладони, как он становится жидким. А на воздухе металл воспламеняется и сгорает. Цезий, изо всех природных металлов, самый химически активный.
Интересное свойство серебра
В IV веке до нашей эры войска Александра Македонского вторглись в Индию. На берегах реки Инд в войсках разразилась эпидемия желудочно-кишечных заболеваний, которая. как ни странно, не затронула ни одного военачальника. Оказалось, что простые воины пользовались оловянной посудой, а их командиры-серебряной. Тогда и вспомнили, что персидский Царь Кир II Великий о время военных походов приказывал хранить питьевую воду в серебряных сосудах. Много позже римские легионеры стали носить панцири, наколенники и поножи из серебра. Серебро обладает бактерицидными свойствами, обезараживая воду, а также способствовало быстрому заживлению ран без нагноений
Цинк, утраченный и обретённый вновь
Этот металл был известен давно. Он входил в состав латуни, производство которого в древнем мире было довольно распространённым. Потом латунь, как исам металл были надолго забыты. Европа вновь узнала о них только в средние века. В сочинениях врача и химика Теофраста Парацельса, относящихся к 1528 г.. имеется запись о том. что привезённый из других стран "нековкий металл содержит большое количество ртути, благодаря чему превращается в жидкость". Металл, о котором идёт речь, впервые в Европе подробно описал в 1721 году саксонский металлург и химик Иоганн Фридрих Генкель, учитель М.В.Ломоносова. Пары металла воспламенялись на водухе с образованием густого белого дыма. Нагретый чуть выше 100 0С металл становился очень ковким и тягучим, а приболее высокой температуре делался хрупким и легко растирался в порошок. Металл реагировал со всеми кислотами-неокислителями. щелочами в водном растворе и аммиаком, всякий раз выделяя водород.Этим металлом был был цинк, который реагирует с кислотами, щелочами и аммиаком в водной среде следующим образом:
Zn+2HCl=ZnCl2+H2
Zn+H2O+2NaOH=Na2[Zn(OH)4]+H2
Zn+H2O+4NH3=[Zn(NH3)4](OH)2+H2
Зелёная ветка таллия
В 1861 году английский физик Уильям Крукс, проводя спектральный анализ отходов сернокислотного производства. нашёл в спектре новуюлинию зелёного цвета, которая не могла принадлежать ни дному известному химическому элементу. Новый элемент, металл получил название таллий, что в переводе с греческого"tallos"- означало "молодая зелёная ветвь". В том же году французский химик Клод Огюст Лями получил и сам металл, который оказался белого цвета с голубоватым оттенком. похожим на свинец. но ещё более мягким, на воздухе металл быстро окислялся и темнел, покрываясь чёрной коркой оксида, который реагирует с водой с образованием сильного основания
"Ароматный" осмий
Осмий серебристо-белый металл-самый тяжёлый из всех: если бы удалось достать полулитровую банку с порошком этого металла, то она весила бы больше, чем 10-литровое ведро с водой, Порошок этого металла на воздухе сгорает, превращаясь в легкоплавкий и летучий тетраоксид с отвратительным запахом. Кстати, название химического элемента произошло от греческого "osme"-запах.
НЕМНОГО ОБ ОТКРЫТИИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
Загадочный франций.
В 1870 году Д.И. Менделеев предсказал существование нового химического элемента "экацезия" с порядковым номером 87, расположенного в первой группе главной подгруппы периодической системы. Долго этот химический элемент не могли найти в природе. Только в 1929 г. химики напали на след "экацезия", но его не могли отделить от примесей других элементов. Одно ошибочное открытие следовало за другим. Как только не называли "экацезий": виргинием, молдавием, руссием, алкалинием... Но вот в 1939 г. за эту взялась Маргарит Пере, ученица Марии Складовской - Кюри. Она обнаружила, что "экацезий" рождается в результате α-распада ядер актиния (элемента, следующего в периодической системе за радием и возглавляющего семейство актиноидов). Пере занялась занялась очисткой препаратов актиния от примесей, и скоро пршёл успех: был открыт новый химический элемент, названный в честь её родной страны францием Fr.аргерит Пере стала первой женщиной Франции, удостоенной звания академика.
Элемент Агриколы.
Этот химический элемент был выделен ещё в XVI веке немецким химиком и металлургом Георгиусом Агриколой. В "Алхимическом словаре" Руланда он отнесён к металлам и назван "легчайшим, бледнейшим, дешевейшим свинцом". Вплоть до ХVII века данный элемент путали со свинцом, сурьмой и оловом. В России его называли то "нимфой ", то "глаурой ", то "демогоргоном ". Одни считают. что оно происходит от арабских слов " би исмид"-похожий на сурьму. Другие предполагают, что название химического элемента древнегерманского происхождения и означает "белый металл". Третьи утверждают, что название произошло от двух немецких слов - "визе" ("луг") и "мутен" ("рудник"), поскольку в немецкой саксонии элемент, о котором идёт речь, издавна добывали в рудниках, расположенных среди лугов округа Шнееберг. Догадались о каком химическом элементе идёт речь ? Правильно - этот химический элемент называется висмутом Bi.
Фиаско Ричарда Ченевикса.
В 1803 году в одной лондонской газете появилось объявление, будто в магазине торговца минералами Форстера, можно приобрести новый металл, близкий по свойствам платине. Надо сказать, что в это время из всех шести металлов семейства платины была известна только сама платина. Английский химик Ричард Ченевикс был возмущён и раздосодован настолько, что купил небольшой образец этого металла, чтобы публично высмеять анонимного химика. якобы открывшего овый элемент. Ченевикс вскоре сообщил. что в руках у него всего-навсего сплав платины со ртутью. Однако другиехимики не подтвердили этого вывода6 новый металл был мягче платины. плавился при более низкой температуре. реагировал с концентрированной азотной кислотой. не выделяя оксидов азота. Соединение нового элемента с кислородом было тёмно - красным, а не чёрным. как у платины. Этот химический элемент был назван палладием. Он был получен химиком Уильямом Вулластом, который и предложил торговцу образцы этого металла для продажи, с тем чтобы проверить, как отнесутся другие химики к его открытию и сумеют ли подтвердить его.
Химический мертвец-аргон.
В 1894 году английский химик Уильям Рамзай открыл новый химический элемент аргон. Этот благородный газ не взаимодействовал ни с какими известными к тому времени элементами, получил прозвище "химический мертвец" и задал химикам немало загадок. В периодической системе ьеста для него не было, ведь атомная масса аргона больше, чем калия и меньше, чем у кальция. Рамзай считал. что аргон следует поместить в периодическую систему после хлора и он должен предшествовать калию, но это была только догадка, в то время ничем конкретным не подтверждённая. Предложение Рамзая разместить аргон и открытые им вслед за этим элементом другие благородные газы в VIII группу поначалу не встретило поддержки Менделеева - ведь у этих химических элементов не было известно ни одного соединения. Только в 1900 году Рамзай и другой английский химик Трэверс убедительно доказали, что аргон и другие инертные газы образуютотдельную группу химических элементов между галогенами и щелочными металлами.
ИСТОРИЯ ОБЫКНОВЕННОЙ СПИЧКИ.

Первая спичка появилась в начале IXвека. Здесь попробую рассказать об истории спички.
Прежде чем в руках человека человека вспыхнула спичка произошло много событий, каждое из которых внесло свою лепту на долгом и сложном пути создания спички.
С незапамятных времён огонь играл важную роль в развитии человечества. Древнегреческие философы Платон и его ученик Аристотель отводили огню особое место. Платон изучал различные природные явления и передавал свой опыт ученикамво время прогулки попарку среди деревьев, которые иногда загорались от небесного огня. Представления Платона о мире сформировались в философскую систему, которая господствовала более двух тысяч лет. В основе системы мироздания лежали четыре стихии: огонь, вода, воздух, земля.
Древние учёные рассматривали огонь как некий феномен. но при этом совершенно исключили его практическое применение.
В греческой мифологии боги ревниво оберегают огонь для себя. они не торопятся отдать его людям, и более того, всячески этому противостоят. Могучий Прометей выручает человечество, он похищает огонь с Олимпа и передаёт его людям.
Использование огня и умение добывать огонь составили одну из характернийших особенностей человеческой культуры даже на ранних этапах развития. Нельзя точно установить, когда первобытные люди стали пользоваться огнём.
Когда же люди научились добывать огонь, то в истории человечества это оказалось крупнейшим событием, которое по сути своей сделало человека человеком. Огонь согрел жилище человека, изменил способ приготовления пищи, научил выплавлять железо и медь, золото и серебро. Изготовление первой глиняной и керемической посуды обязано огню.
Первый огонь был добыт человеком примитивным способом - трением двух кусочков дерева, причём древесная пыль и опилки нагревались настолько сильно, что происходило их самовозгорание.
На смену деревянным палочкам пришло знаменитое огниво. Это очень простое устройство: куском стали или медным колчеданом ударяли о кремень т высекали искры, которые воспламеняли какое - то горючее вещество.Как это не удивительо, но всего лишь чуть более 200 лет назад в России. да и во всём мире стальное огниво и фитиль были практически единственными "спичками" человека, сумевшего не только построить египетские пирамиды, но и создать паровую машину Джеймса Уатта. первый пароход Роберта Фултона, ткацкие станки и множество других великих изобретений, но только не спички.
Древние греки и римляне знали ещё один способ добывания огня - при помощи солнечных лучей. сфокусированных линзой или вогнутым зеркалом. Великий древнегреческий учёный Архимед ловко воспользовался этим способом и поджёг, как утверждает легенда, вражеский флот с помощью громадного зеркала.
После 1700 года было изобретено значительное количество средств для получения огня, наиболее интересное из них - зажигательный аппарат Дёберайера, созданный в 1823 году. Изобретатель аппарата использовал свойство гремучего газа воспламеняться в присутствии губчатой платины. Однако это устройство было малопригодным.
Большой шаг вперёд в изготовлении спичек был сделан,когда был открыт и получен фосфор.Немецкий учёный А. Ганквитц догадался изготовить спички с серным покрытием, зажигающиеся при трении о кусочек фосфора. Но этот шаг следовало усовершенствовать и сделатб спички более удобными для широкого употребления.
Это стало возможным, когда знаменитый французский химик К. Бертолле получил соль хлорат калия KClO3, названную бертолетовой. Его соотечественник Шансель воспользовался этим открытием и изобрёл в 1805 году так называемые французские зажигательные машины. Хлорат калия вместе с серой. смолой, сахаром наносился на деревянную палочку, и при соприкосновении с концентрированной серной кислотой происходило зажигание. Реакция порой развивалась очень бурно и носила взрввной характер.
Немец Вагеманн использовал в 1806 году изобретение Шанселя, но добавил кусочки асбеста для замедления процесса горения. Он позднее построил первую фабрику по изготовлению зажигательных устройств.
В 1832 году в Вене появились сухие спички. Их изобрёл Л. Тревани, он покрыл головку деревянной соломки смесью бертоллетовой соли с серой и клеем. Если такой спичкой провести по наждачной бумаге, то головка воспламеняется, но иногда это происходило со взрывом, и это приводило к серьёзным ожогам.
Пути дальнейшего усовершенствования спичек были предельно ясны: надо сделать такой состав смеси для спичечной головкия. чтобы она загоралась спокойно. Вскоре проблема была решена. В в новый состав входили бертолетова соль, белый фосфор и клей. Спички с таким покрытием легко воспламенялись о любую твёрдую поверхность, о стекло, о подошву обуви, о кусок дерева.
Изобретателем первых фосфорных спичек оказался Девятнадцатилетний француз Шарль Сориа. В 1831 году юный экспериментатор к смеси бертолетовой соли с серой для ослабления его взрывчатых свойств добавил белый фосфор. Эта идея оказалась удачной, поскольку лучинки смазанные полученным составом легко загорались при трении.Температура воспламенения таких спичек сравнительно небольшая - 30 градусов.Учёный хотел запатентовать своё изобретение, но за это надо было заплатить большие деньги, которых он не имел. Спустя год спички были вновь созданы немецким химиком Я.Каммерером.
Эти спички спички легко воспламенялись, поэтому послужили возникновению пожаров, да к тому же белый фосфор очень ядовитые вещество. Рабочие спичечных фабрик страдали серьёзными заболеваниями, вызванные парами фосфора.
Проблема была решена в 1855 году в Швеции. Безопасные спички в этом же году были представлены на Международной выставке в Париже и получили золотую медаль. С этого момента спичка начала триумфальное шествие по всему миру. Их главная особенность состояла в том, что они не воспламенялись при трении о любую твёрдую поверхность. Шведская спичка зажигалась только в том случае, если её потереть о боковую поверхность коробки, покрытую специальной массой.
Как же устроена современная спичка? Масса спичечной головки на 60% состоит из бертолетовой соли, а также из горючих веществ - серы или сульфидов металлов. Чтобы воспламенение головки происходил медленно и равномерно, без взрыва, к массе добавляют так называемые наполнители - стеклянный порошок, оксид железа (III) и т.д. Связующим материалом является клей.
А из чего состоит намазка шкурки? Основной компонент красный фосфор. К нему добавляют оксид марганца (IV), толчёное стекло и клей.
Какие же процессы протекают при зажигании спички? При трении головки о шкурку в точке их соприкосновения красный фосфор загорается благодаря кислороду бертоллетовой соли. Образно говоря, огонь первоначально рождается в шкурке. Он и поджигает головку спички. В ней вспыхивает сера или сульфид опять же за счёт кислорода бертолетовой соли. А уже затем загорается дерево.
ИОД И ЩИТОВИДНАЯ ЖЕЛЕЗА.
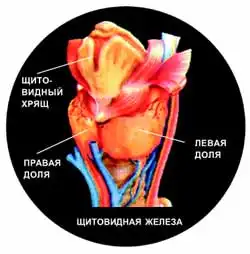
Щитовидная железа - одна из самых крупных желез внутренней секреции: у взрослого человека она весит 15-20 г и состоит из двух долей длиной 4 см и шириной 2-2,5 см, соединенных перешейком. Своим наименованием она обязана анатомической близости к хрящу гортани, который очертаниями напоминает щит. Иногда щитовидная железа может располагаться не за хрящом, а, например, в корне языка или за грудиной. У некоторых людей она отсутствует совсем. Если раньше младенцы, родившиеся без щитовидной железы, были обречены, то сейчас синтетические гормональные препараты полностью компенсируют отсутствие в крови естественных тиреоидных гормонов.
Назначение железы - вырабатывать тиреоидные гормоны: тироксин и трийодтиронин. Для нормального функционирования щитовидной железы совершенно необходим йод, поскольку он входит в состав гормонов: тироксин содержит четыре атома йода, а трийодтиронин - два.

Организм не может синтезировать йод самостоятельно, мы получаем его исключительно с продуктами питания.
Что происходит, если йода в пище недостаточно? Чтобы захватить больше йода, щитовидная железа начинает разрастаться - увеличивается количество и объем тиреоидных клеток, - образуется зоб. Так организм компенсирует недостаток йода. Но если нехватка йода сохраняется достаточно долго, увеличение объема железы не нормализует потребление йода и появляются симптомы йододефицита.
Тиреоидные гормоны регулируют рост и развитие клеток, функции центральной и периферической нервных систем, мышечной, репродуктивной, костной, сердечно-сосудистой, дыхательной и других систем организма. И самое главное - они могут управлять процессами синтеза белков. Другой, очень важный эффект действия тиреоидных гормонов - способность стимулировать клеточное и тканевое дыхание в митохондриях. Поэтому дефицит йода приводит к тяжелым последствиям: снижаются умственные способнос ти, появляются апатия и сонливость, нарушается обмен веществ.
Щитовидная железа расположена вблизи передней поверхности шеи, чуть ниже щитовидного хряща. По форме она напоминает бабочку.
За всю жизнь человек потребляет лишь 3-5 г йода. Йод как микроэлемент входит в состав многих природных органических соединений или присутствует в неорганических солях в виде йодид-аниона. 10-20% от общего количества поступившего в организм йода избирательно поглощает щитовидная железа, в которой обычно сконцентрировано 6000-8000 мкг. В крови же циркулирует 500-600 мкг йода. Ежедневно щитовидная железа расходует 75 мкг йода на нужды организма. Суточная потребность всего организма составляет 100-200 мкг йода в зависимости от возраста и состояния здоровья. Врачи-эндокринологи рекомендуют следующие нормы потребления йода:
детям от 2 до 6 лет 90 мкг
детям от 7 до 12 лет 120 мкг
взрослым от 12 лет и старше 150 мкг
беременным и кормящим женщинам 200 мкг
Таким образом, самое большое количество йода требуется беременным женщинам. Это неудивительно: для развития плода необходимы тиреоидные гормоны. Щитовидная железа плода начинает работать с 12-й недели беременности, поэтому первые три месяца эмбрион развивается исключительно за счет тиреоидных гормонов матери. Если их недостаточно, страдает весь организм будущего ребенка, и прежде всего его мозг. Кроме того, дефицит йода опасен и для матери, поскольку потребление йода организмом во время беременности возрастает. А значит, недостаток его в пище беременной женщины может привести к быстрому развитию зоба.
Почти все население Российской Федерации, за исключением жителей морских побережий, проживает в районах с легким, умеренным и тяжелым природным дефицитом йода. Но это - не единственная причина развития заболеваний щитовидной железы. В овощах, принадлежащих к семейству крестоцветных, содержатся органические соединения с SCN-группой: тиоцианаты и изотиоцианаты. К этому семейству относятся белокочанная, брюссельская и цветная капуста, брокколи, репа, хрен, кресс-салат. Доказано, что тиоцианаты и изоти оцианаты - вещества, способствующие развитию зоба, - зобогены. Другую группу пищевых зобогенов составляют продукты, содержащие вещества - предшественники тиоцианатов. К ним относятся маниока, кукуруза, сладкий картофель, бобы, маис. Зобогенными свойствами обладают уголь, сланцы, бытовые и промышленные отходы, химические удобрения и пестициды. Тиоцианаты содержатся и в табаке. Все эти продукты нарушают процессы синтеза тиреоидных гормонов, усугубляя природный йодный дефицит.
Восполнить недостаток йода можно разными способами. Наиболее эффективный и экономичный метод - йодирование поваренной соли и хлеба. Этот метод профилактики называется "немым": человек зачастую не знает, что употребляет в пищу продукт питания, обогащенный йодом. В настоящее время в России принят новый стандарт, который предполагает внесение в поваренную соль 40±15 мг йода на килограмм. Применение йодированной поваренной соли во многих случаях способно ликвидировать йодный дефицит. Однако в определенные периоды жизни (детский и подростковый, беременность, кормление грудью) организм нуждается в регулярном дополнительном приеме физиологических доз йода. В таких случаях назначают препараты, содержащие физиологическую дозу калия йодида, например Йодомарин, одна таблетка которого содержит дневную дозу йода.
Можно ли нормализовать уровень йода иным способом? Безусловно, если ежедневно употребл*ть в пищу устриц, трепангов, кальмаров, морскую капусту и морские гребешки, как делают японцы. Они потребляют до 1500 мкг йода в день и не болеют зобом. В наших же условиях наиболее целесообразно регулярно использовать йодированную соль, как это делают австрийцы, швейцарцы, французы, проживающие в условиях тяжелого природного йодного дефицита, и принимать "Йодомарин".
ЗАПАХИ И ВКУСЫ
Нос химика, работающего в большой лаборатории, ежедневно подвергается серьезным испытаниям. Ведь некоторые вещества уже в ничтожно малых количествах способны выгнать человека из комнаты. Какие же вещества имеют самый неприятный запах и к каким человеческий нос наиболее чувствителен?
Распространено мнение, что человек более чувствителен к неприятным запахам. Например, свободная масляная кислота, как и все карбоновые кислоты с небольшим числом атомов углерода, обладает резким отвратительным запахом; поэтому, когда масло портится, масляная и другие кислоты выделяются в свободном состоянии и придают ему неприятный (прогорклый) запах и вкус. А вот другой пример. Чеснок и лук резко пахнут потому, что выделяют сернистые соединения: чеснок – в основном диаллилдисульфид (CH2=CH–CH2)2S2 и аллицин (от латинского названия чеснока Allium sativum) CH2=CH–CH2–SO–S–CH2–CH=CH2, лук – аллилпропилдисульфид CH2=CH–CH2–S–S–CH2–CH–CH3. Интересно, что в самих чесноке и луке этих соединений нет, но есть много аминокислоты цистеина с сульфгидрильными группами –SH. При разрезании чеснока или лука эти аминокислоты под действием ферментов превращаются в пахучие дисульфиды. В луке происходит одновременно образование тиопропиональдегид-S-оксида CH3–CH2–CH=S=O, который является довольно сильным лакриматором (от латинского lacrima – слеза), т.е. вызывает слезотечение. Кстати, упомянутые дисульфиды обладают редкой особенностью. Многие замечали, что от запаха лука или чеснока почти невозможно избавиться: не помогает ни чистка зубов, ни полоскание рта. А дело в том, что эти соединения выделяются не изо рта, а из легких! Дисульфиды, проникнув из пищи в стенки кишечника и далее – в кровь, разносятся ею по всему организму, в том числе и в легкие.
Там они и выделяются с выдыхаемым воздухом.
Одним из самых неприятных запахов обладают тиолы или меркаптаны с общей формулой R–SH (второе название отражает способность этих соединений связывать ртуть, по-английски это свойство называется mercury capture). К природному газу, который горит в плите на кухне (в основном это метан), добавляют ничтожные количества очень сильно пахнущего вещества, например изоамилмеркаптана (CH3)2CH–CH2–CH2–SH, что позволяет обнаружить по запаху утечку газа в жилых помещениях: человек способен почувствовать запах этого соединения в количестве двух триллионных долей грамма! Однако изредка встречаются люди (примерно 1 человек из 1000), которые не чувствуют запаха меркаптана. Может быть, этим частично объясняются случаи взрывов при утечке газа? «Запаховый дальтонизм», по-научному аносмия (от греч. osme – запах), изредка распространяется на все запахи, чаще – на некоторые определенные (специфическая аносмия). Так, 2% людей не ощущают сладковатого запаха изовалериановой кислоты, 10% не чувствуют запаха ядовитой синильной кислоты, 12% не ощущают запаха мускуса, 36% – солода, 47% – гормона андростерона.
Меркаптаны придают запах крайне зловонному секрету скунса – небольшому зверьку семейства куньих (другое его название – вонючка). Описаны случаи, когда люди теряли сознание, вдохнув выделения этих животных, и даже на следующий день чувствовали головную боль. Когда химики подробно проанализировали выделения скунса, в них обнаружили 3-метилбутантиол (изоамилмеркаптан) (CH3)2CH–CH2–CH2–SH, транс-2-бутен-1-тиол кротилмеркаптан) CH3–CH=CH–CH2–SH и транс-2-бутенилметилдисульфид CH3–CH=CH–CH2–S–S–CH3. Но бывают, оказывается, запахи и похуже. В знаменитой книге рекордов Гиннеса к самым зловонным химическим соединениям отнесены этилмеркаптан С2Н9SН и бутилселеномеркаптан С4Н9SеН – их запах напоминает комбинацию запахов гниющей капусты, чеснока, лука и нечистот одновременно. А в учебнике А.Е.Чичибабина Основные начала органической химии сказано: «Запах меркаптанов – один из самых отвратительных и сильных запахов, какие встречаются у органических веществ... Метилмеркаптан CH3SH образуется при гидролизе кератина шерсти и гниении белковых веществ, содержащих серу. Он находится также в человеческих испражнениях, являясь вместе со скатолом (b-метилиндолом) причиной их неприятного запаха».
От противных запахов обычно избавляются, забивая их более сильным запахом какого-либо дезодоранта, который при частом употреблении сам может стать причиной неприятных ассоциаций. Забавен патент США от 1989 на «шампунь от скунса», в состав которого входит 2%-ный раствор иодата калия KIO3. Это соединение легко окисляет меркаптаны и дисульфиды до сульфоксидов, сульфатов или сульфонов, которые запахом не обладают.
И все же рекорд чувствительности принадлежит соединению с приятным запахом. В Книге рекордов Гиннеса утверждается, что это вещество – ванилин: его присутствие в воздухе можно почувствовать при концентрации 2·10–11 г в одном литре. Однако этот рекорд в 1996 был побит. Новый рекордсмен – так называемый винный лактон, производное метилциклогексена с довольно простой формулой С10Н14О2; он придает красным и белым винам сладковатый «кокосовый» аромат. Поразительна чувствительность носа к этому веществу: его можно почувствовать при концентрации 0,01 пикограмма (10–14 или одна стотриллионная грамма) в 1 л воздуха. Не менее удивительно, что эта особенность свойственна только одному из пространственных изомеров лактона, тогда как запах его антипода можно почувствовать лишь при концентрации 1 мг/л, что на 11 порядков больше!
Как обычно, есть здесь и своя ложка дегтя. Так, 2,4,6-трихлоранизол СН3ОС6H2Cl3 придает винам (естественно, не самым качественным) «корковый» запах. Опытные дегустаторы способны обнаружить присутствие этого соединения при содержании 10 нг (нанограммов) в 1 л.
К счастью, это на 6 порядков больше, чем у винного лактона. Предполагают, что трихлоранизол действительно образуется в корковой пробке бутылки под действием микроорганизмов. Не исключено, что первоисточником этого вещества являются хлорсодержащие инсектициды, которыми уничтожают насекомых в винных подвалах.
Другие знакомые всем пахучие вещества далеко отстают от рекордсменов. Однако некоторые из них имеют поразительную стойкость. В городе Марракеше в Марокко находится минарет – башня высотой около 70 м, построенная по приказу султана в знак победы над испанцами. Минарет знаменит тем, что его стены пахнут мускусом. Натуральный мускус – ценное благовоние, которое вырабатывают железы самца кабарги – животного семейства оленей.
Запах мускусу придает 3-метилциклопентадеканон-1 (мускон). Оказывается, при строительстве минарета в 1195 в цемент, скрепляющий камни, подмешали около тысячи мешков мускуса. И запах не исчез даже спустя 800 лет...
Если бы для определения рекордсменов по части запаха использовали не только человеческий нос, результаты изменились бы очень сильно. Известно, например, насколько нюх собаки тоньше нашего. Несравнимо более чувствительны органы обоняния насекомых.
Сигналом для них являются особые вещества – феромоны . Чувствительность к ним удивительна. Например, муравьи вида Atta texana используют метиловый эфир 4-метилпиррол-2-карбоновой кислоты, чтобы метить свои тропы. Всего одного миллиграмма этого соединения достаточно, чтобы пометить тропинку, втрое длиннее земного экватора! Муравью достаточно синтезировать для своих надобностей всего 3 нг этого соединения. Еще более чувствительны к феромонам бабочки – их самцы чувствуют присутствие самок на расстоянии нескольких километров. Некоторые бабочки обнаруживают присутствие феромонов, если в 1 см3 воздуха содержится одна-единственная молекула! Для сравнения: винный лактон мы чувствуем при концентрации 10–17 г/см3, что при молекулярной массе 134 соответствует 45000 молекул/см3.
Феромоны обычно имеют молекулярную массу от 100 до 300. Самый же простой по строению «сигнальный агент» – диоксид углерода (углекислый газ). Он служит феромоном для некоторых видов муравьев. Оказавшись далеко от муравейника, рабочие муравьи находят дорогу домой, двигаясь в сторону увеличения концентрации СО2, которая максимальна около скопления муравьев. Привлекает этот газ и личинок некоторых червей, питающихся корнями кукурузы. Вылупившись, крошечные личинки способны в поисках пищи пройти путь в земле до 1 метра, руководствуясь «запахом» СО2, который выделяют корни растений.
Очень интересны взаимоотношения между смоковницами, их плодами и живущими в них
фиговыми осами. Когда инжир созревает, концентрация СО2 в ягодах повышается на 10%. Этого достаточно, чтобы усыпить осиных самок. Самцы же остаются активными, оплодотворяют самок и вылетают наружу, проделав в ягодах ход. Через эти дырочки избыток СО2 улетучивается, самки просыпаются и тоже покидают ягоды, заодно унося на своих щетинках пыльцу растения.
Ученые давно пытались понять, почему- то или иное вещество пахнет так, а не иначе, однако единой теории запаха до сих пор нет, и для этого есть причины: слишком много человек различает различных запахов (около 10 тысяч), слишком их восприятие индивидуально. Физиологи давно установили, что окончания нюхательных нервов – рецепторы у человека расположены в эпителии, выстилающем верхнюю поверхность полости носа. Эти чувствительные клетки передают обонятельные ощущения в сенсорные области головного мозга. Особенно чувствительны к запахам парфюмеры, создающие новые композиции – композиторы духов. Однако не следует думать, что парфюмеру работать – одно удовольствие. Ведь запах многих веществ может сильно зависеть от его концентрации. Все знают, что сероводород пахнет тухлыми яйцами (правильнее сказать, что тухлые яйца пахнут сероводородом). Однако в очень малых концентрациях этот ядовитый газ приятно пахнет свежесваренным яйцом. А вот еще более удивительный пример. При разложении белковых соединений образуется скатол (b-метилиндол), одно из производных бензола. Именно это отвратительно пахнущее соединение придает специфический запах испражнениям. Однако в очень малых концентрациях скатол не только имеет приятный запах, но и используется в парфюмерии для придания изделиям цветочного запаха и как фиксатор. Более того, в небольших количествах скатол добавляют к некоторым пищевым эссенциям!
Приведенный пример – не исключение, а скорее правило. Еще в 19 в. химики обнаружили, что альдегиды молекулы которых содержат длинную цепочку из атомов углерода, являются душистыми веществами. Они могут иметь запах земляники, розы, свежей травы, лимона, апельсиновой корки, мимозы. Причем ощущение запаха зависит от концентрации. Так, кокосовый альдегид имеет, как можно догадаться из названия, запах кокоса, однако в сильно разбавленном состоянии он приобретает совершенно иной запах абрикоса или персика. Анисовый альдегид, в зависимости от концентрации, пахнет либо свежим сеном, либо шиповником, либо цветами боярышника. Вообще в концентрированном виде альдегиды, собенно летучие, имеют довольно резкий и даже раздражающий запах, но при сильном разбавлении у них неожиданно появляется нежный цветочный аромат. Поэтому в малых концентрациях альдегиды – непременная составная часть самых ценных эфирных масел, в том числе розового; они придают парфюмерным композициям особую свежесть и потому без них не обходятся ни одни высококачественные духи.
Одна из теорий запаха исходит из того, что молекула пахучего вещества подходит к
обонятельному рецептору в носу, как ключ к замку. В пользу этой теории говорили разные запахи пространственных (оптических) изомеров одного и того же вещества, молекулы которых отличаются как правая рука от левой или как предмет от его зеркального изображения. Такие молекулы называются хиральными (от греческого heir – рука). Так, из тмина и кудрявой мяты выделены два изомерных вещества – d-карвон и l-карвон. Каждый согласится с тем, что запах мяты и тмина вовсе не одинаковы. Подобные примеры показывают, что клетки-рецепторы в носу, ответственные за восприятие запаха, также должны быть хиральными.
В отношении вкусов все далеко не однозначно, и это связано с некоторыми физиологическими особенностями вкусовых ощущений. Во-первых, вкус вещества очень часто зависит от запаха.
Это особенно заметно, когда у человека сильный насморк: при исключении обоняния самая вкусная еда и лучшие напитки утрачивают для человека всю свою прелесть. Физиологи обнаружили даже, что человек с завязанными глазами и зажатым носом (чтобы не чувствовать запаха пищи) вряд ли сможет отличить яблоко от картошки или даже от лука, красное вино от кофе и т.п. Для обозначения сочетания вкуса и запаха в некоторых языках даже существуют специальные слова (например, flavour в английском, что примерно соответствует нашему термину «букет» по отношению к винам).
Во-вторых, вкус одного и того же вещества, оказывается, не является постоянной величиной и может очень сильно отличаться у разных людей. Так, описан случай, когда один пробующий уловил горечь фенилтиомочевины при ее концентрации в растворе всего лишь 0,01 мг/л, в то время как другие не обнаружили то же вещество, когда его было 2,5 г/л, т.е. 250 тысяч раз больше! Бывают еще более удивительные вещества, имеющие для разных людей несколько «разных вкусов». Например, натриевая соль бензойной кислоты (С6Н5СООNa) одним кажется сладковатой, другим кислой, третьим горькой, а некоторым вообще безвкусной. Рассказывают о химике-шутнике, который под видом эксперимента давал группе людей попробовать слабый раствор этого вещества (он безвреден и даже используется в качестве консерванта; бензойная кислота, присутствующая в ягодах брусники, не дает ей портиться), а затем просил рассказать о своих ощущениях. Как правило, разгоралась перепалка: люди никак не могли понять, по какой причине другие говорят неправду.
Наконец, даже для одного человека вкус конкретного вещества может сильно изменяться в зависимости от обстоятельств. Еще в прошлом веке ботаники описали африканский кустарник, красные плоды которого местные жители называли «чудодейственными». У пожевавшего эти плоды человека изменяются вкусовые ощущения – у уксуса появляется приятный винный вкус, а лимонный сок превращается в сладкий напиток. Другие вещества усиливают тот или иной вкус. Некоторые из них специально добавляют в пищу. Например, натриевая соль глутаминовой кислоты (HOOC–CH2–CH2–CH(NH2)–COOH) придает мясной вкус различным блюдам, даже если в них вообще нет мяса. Известны и вещества, вообще отбивающие вкусовые ощущения – как у человека, так и у животных. К ним принадлежат, например, некоторые тиолы. Небольшие количества солей меди и цинка возвращают вкус, что не удивительно, так как ионы этих металлов способны прочно связываться с тиолами, образуя солеобразные соединения.
Все эти обстоятельства весьма затрудняют определение «рекордсменов» вкуса. Можно, однако, привести «типичные образцы» вкусов, которых обычно насчитывают четыре: сладкий, соленый, кислый, горький. Все остальные вкусы можно получить комбинацией четырех остальных. (Правда, некоторые физиологи считают, что существует больше четырех основных вкусов, прибавляя к ним, например, жгучий вкус, «металлический», ментоловый и др.).
Образцом горького может служить хинин, сладкого – сахароза (обычный свекловичный или тростниковый сахар), соленого – хлорид натрия (поваренная соль), кислого – любая кислота с «безвкусным» анионом.
Чувствительность языка неодинакова к «разным вкусам». На первом месте чаще всего стоят вещества горькие. Это именно тот случай, когда ложка дегтя портит бочку меда. Действительно, вкус таких горьких веществ, как хинин и стрихнин, отчетливо воспринимается при разведении 1:100 000 и более (это примерно чайная ложка вещества, разведенная в полутонне воды!).
Хинин – самое распространенное средство от малярии. Описаны случаи, когда после приема хинина в капсулах (чтобы исключить непосредственный контакт лекарства с языком), люди жаловались на горький вкус во рту. Вероятно, это объясняется тем, что, попав в кровь, хинин возбуждает вкусовые нервы «изнутри языка». Однако в очень малых концентрациях горький вкус может быть приятен; так, в некоторые напитки добавляют хинин (обычно в виде сернокислой соли). Обнаружить хинин в тонике можно не только по вкусу, но и по яркому светло-голубому свечению напитка под лучами ультрафиолетовой лампы.
Самым жгучим вкусом обладает, вероятно, одно из производных ванилина – капсаицин (от латинского названия стручкового перца Capsicum). Больше всего его в однолетнем перце Capsicum annum – около 0,03%. Если пожевать немного этого перца, потом очень долго трудно избавиться от жгучей боли в языке. Человек может переносить вкус этого соединения в течение 2 минут, если его концентрация не превышает 0,004 мг/л. Капсаицин известен с 1876, а в 1989 был выделен растительный яд ресинифератоксин, который обладает аналогичным физиологическим действием, но в концентрациях, в 10 000 раз меньших!
Чувствительность языка к соленому, кислому и сладкому обычно довольно низка, в чем нетрудно убедиться экспериментально. Так, даже опытный дегустатор может почувствовать присутствие сахарозы в воде лишь при ее концентрации около 3,5 г/л. Фруктоза – самый сладкий из природных сахаров – слаще сахарозы всего в 1,7 раза. Однако бывают и исключительно сладкие соединения. Их поиск стимулировала необходимость замены природного сахара малокалорийными соединениями, а также сладкими веществами, безвредными для диабетиков. Одним из первых был сахарин – имид о-сульфобензойной кислоты, случайно открытый в 1878 (химик сел обедать, не вымыв тщательно руки после работы). Сахарин слаще сахара примерно в 500 раз.
В 1969 обнаружили, и тоже случайно, что у метилового эфира L-альфа-аспартил-L-фенилаланина CH3OOC–CH(CH2C6H5)–NH–CO–CH(NH2)–CH2–CO
OH очень
сладкий вкус. Вещество получило известность под торговым названием «аспартам». Аспартам не только слаще сахара (в 180 раз), но и усиливает его сладкий вкус, особенно в присутствии лимонной кислоты.Опыты с аспартамом показали, что субъективная оценка сладости не увеличивалась плавно с концентрацией раствора: сначала оценка сладости в баллах растет быстро, а затем все медленнее. Объяснить это можно так. По мере роста концентрации аспартама его молекулы связываются со все большим числом вкусовых рецепторов языка, которые отвечают за распознавание сладкого вкуса. Соответственно усиливается ощущение сладости. Но когда аспартама становится достаточно много, почти все вкусовые рецепторы оказываются «заняты», так что дальнейшее увеличение концентрации уже мало отражается на сладости раствора.
Трудно описать, каков вкус у грейпфрута – смесь сладкого, кислого и горького. Но именно из их плодов, переработав 100 л сока, химики выделили в 1982 рекордсмена вкуса. Как ни удивительно, но он оказался меркаптаном, его химическое название – 1-п-ментен-8-тиол. Вкус этого соединения можно почувствовать при концентрации всего 0,02 нг/л. Для получения такой концентрации в огромном танкере со 100 000 тонн воды надо растворить всего 2 мг вещества.
Говорим спасибо и оцениваем)
