Достижения теоретической и экспериментальной физики: законы термодинамики как часть нашей жизни
Вчера во время распития чая я обжег себе язык. Почему? А потому что жена разогрела чайник до 98 градусов, а я его разогреваю обычно до 70. В этом случае вода чуть горячее теплой, но и не очень горячая - по мне самое то. И вот, недовольно простонав, я подумал о термодинамике (дурак, нет бы подумать о том, что языку больно) и что можно ей посвятить пост. Итак, давайте обратимся к очень интересной области физики - термодинамике...
Термодинамика - это область физики, изучающая соотношение между теплотой и различными формами энергии. Главное содержание термодинамики - это описание превращения теплоты в механическую работу и, обратно, превращения механической работы в теплоту. Собственно говоря, вся термодинамика содержится в паре-тройке утверждений, которые называются законами термодинамики.
Можно сказать, что термодинамика началась в первой половине 19 века с работ инженера Сади Карно, который размышлял над тем, как построить наиболее эффективную паровую машину с непрерывной циркуляцией процесса кипячения воды с помощью вырабатываемого в этой машине тепла. Результатом его размышлений явилось ясное понимание тех ограничений, которые всегда имеются при преобразовании теплоты в работу, т.е. по существу того, что теперь называется вторым законом термодинамики. Лишь через пару десятков лет после этого Роберт Майер открыл эквивалентность теплоты и механической работы, и первый сформулировал принцип сохранения энергии - первый закон термодинамики. Ну и уже в самом начале 20 века Вальтер Нернст добавил то, что многие называют третьим законом термодинамики, который объясняется только в терминах квантовой механики. В отличие от первых двух, которые обосновываются классической механикой. Итак, поговорим об этих трех законах.
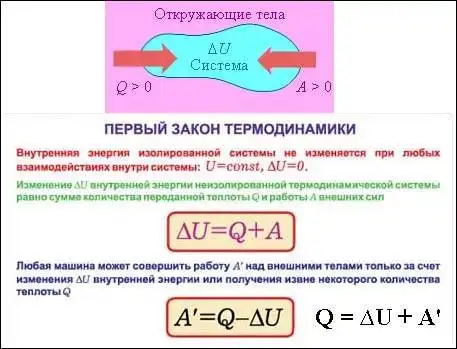
Несмотря на то, что второй закон был открыт раньше первого закона, все-таки начнем с последнего. Первый закон термодинамики, как уже говорилось, представляет собой формулировку принципа сохранения энергии для термодинамических систем. Если дана такая система, мы подводим к ней тепло и производим над ней какую-то работу, то приращение энергии системы равно подведенному теплу и затраченной работе.
Первый закон является обобщением опытных фактов. Из этого закона вытекает, что энергия не появляется из ниоткуда и не исчезает в никуда, она лишь преобразуется из одной формы в другую и передается от одной системы к другой. Важнейшим следствием первого закона явилось утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких-либо изменений внутри самой машины. Такая гипотетическая машина получила название Вечного двигателя (Perpetuum mobile) первого рода. Как известно, попытки создать такую машину обязательно заканчивались провалом. Любая машина может совершать полезную работу над внешними телами только за счет получения некоторого количества теплоты от окружающих тел или уменьшения своей внутренней энергии.
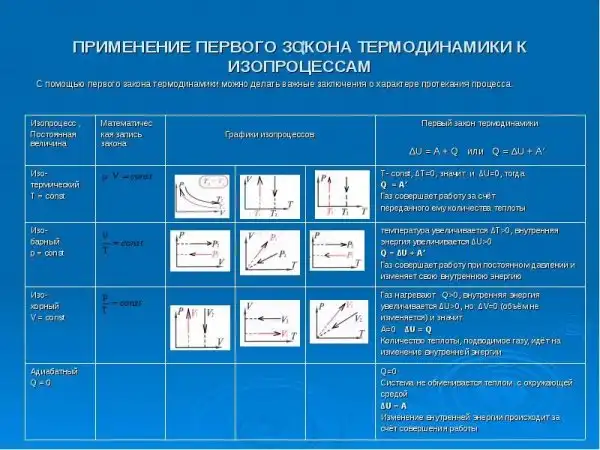
Первый закон термодинамики проявляется в известных процессах в газах: изохорном, изобарном, изотермическом и адиабатическом. Кратко это показано на картинке ниже. Здесь без графиков и формул не обойтись, так что об этом можно почитать, кому интересно, но не в пределах этого поста. Что можно привести в качестве простейшего примера преобразования одной формы энергии в другую? Если рассмотреть механическую изолированную систему, то например груз, который мы подвесили на какой-нибудь балке, обладает потенциальной энергией в силу того, что находится в поле тяжести Земли, на некотором расстоянии от ее поверхности. Если мы отцепим груз от балки, он начнет падать и его потенциальная энергия преобразуется в кинетическую - энергию движения.
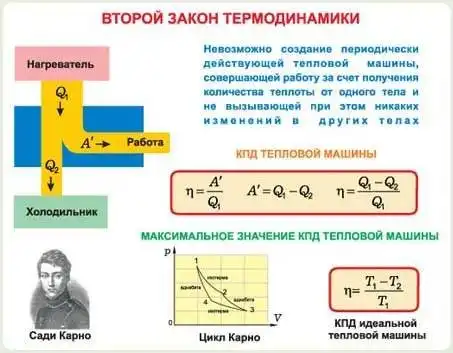
Каково же содержание второго закона термодинамики? Первый закон был сформулирован как невозможность построить машину, которая могла бы создавать энергию. Но он не накладывает ограничений на преобразование энергии из одного вида в другой. Т.е. на основе одного лишь первого закона всегда есть возможность превратить теплоту в работу или работу в теплоту, если общее количество теплоты эквивалентно общему количеству работы. Это верно для превращения работы в теплоту. Например, электрическая энергия всегда может быть преобразована в теплоту при прохождении электрического тока через сопротивление. Но существуют определенные ограничения при превращении теплоты в работу. Если бы этого не было, то можно было бы построить машину, которая смогла бы путем охлаждения окружающих тел превращать взятую из окружающей среды теплоту в работу. Друзья, вам ничего это не напоминает? ) может быть вы сразу смекнули и подумали о старом добром холодильнике, который мог бы охлаждать продукты, но при этом не быть подключенным к внешнему источнику электрической энергии? Такую гипотетическую машину тоже называют Perpetuum mobile, только уже второго рода. Так вот второй закон исключает возможность построения Perpetuum mobile второго рода. Возвращаясь к размышлениям Карно, он понял, что при постоянной температуре нельзя извлечь тепло из его источника и превратить в работу, не производя больше никаких изменений в заданной нам системе или в окружающем пространстве. Каждый в курсе, что тепло переходит от горячего тела к холодному и мы не сможем без всяких затрат отнять тепло у холодного тела и отдать его горячему.
Итак, теперь мы можем сформулировать второй закон термодинамики. Вообще существует два эквивалентных утверждения второго закона (эквивалентность этих утверждений была доказана). Первое утверждение является постулатом Кельвина и формулируется так: невозможен процесс, единственным конечным результатом которого будет превращение в работу теплоты, извлеченной из источника, имеющего всюду одинаковую температуру. Что является самым лучшим экспериментальным доказательством этого утверждения? А главным образом то, что все попытки сконструировать Perpetuum mobile второго рода закончились неудачей.
Теперь приведем второе утверждение второго закона, являющееся постулатом Клаузиуса: невозможен процесс, единственным конечным результатом которого был бы переход теплоты от тела с данной температурой к телу с более высокой температурой. Что здесь имеется ввиду? А то, что если например при контакте тел А и Б теплота переходит от А к Б, то невозможен процесс, при котором тепло переходило бы от Б к А. Моя чашка чая не сможет нагреваться при одновременном остывании окружающего воздуха, а лед не станет холоднее в стакане воды. Кстати говоря, Карно раньше Клаузиуса умозрительно вывел это утверждение, но Клаузиус сформулировал более понятно и доступно, поэтому обычно придерживаются постулата Клаузиуса.
Идем дальше. Если бы я на этом закончил со вторым законом, я бы кое-что упустил. Существует функция, тесно связанная со вторым законом. Эта функция - энтропия. Строго говоря, именно энтропия препятствует передаче тепла от более холодного тела к более горячему. Понятие энтропии является центральным для понимания того, почему в природе какие-то процессы могут происходить, а какие-то - нет. В любой изолированной системе оказываются возможными только те процессы, при которых энтропия возрастает либо остается постоянной. Все процессы, при которых энтропия уменьшается, строго запрещены. Как это по-простому? Например, когда в комнате полнейший порядок, энтропия постоянна. Но вечно это продолжаться не может - неизбежно появляется пыль, появляется беспорядок, это означает, что энтропия возрастает. Обратный процесс, происходящий сам по себе, т.е. самоликвидация пыли - невозможен, энтропия не может уменьшаться. Т.е. энтропия - это функция состояния системы. Когда моя чашка чая остывает, окружающий воздух становится теплее, потому что энергия рассеивается и необратимо теряется, что и обеспечивает невозможность обратного процесса.
Нужно сказать, что теория энтропии напичкана формулами и графиками, поэтому сложновато все это превратить в доступные и понятные слова. Но можно попробовать. Клаузиус определил энтропию как количество тепла, получаемого или отдаваемого телом или системой, деленное на температуру, при которой происходит процесс. Покажем, что энтропия системы всегда будет возрастать. Допустим, моя чашка чая с температурой 95 градусов передает 475 единиц энергии в окружающую среду (кухня), температура которой 25 градусов. При этом энтропия чашки с чаем уменьшается: -475/95 = -5. Если более холодная окружающая среда при температуре 25 градусов принимает эти 475 единиц энергии, то энтропия этой среды возрастает: 475/25 = 19. Суммарная энтропия системы, в которую входит моя чашка с чаем и моя кухня, определяется как -5+19=14, т.е. возрастает на 14 единиц на градус.
Получается, что все процессы, действительно имеющие место, необратимы, потому что должны приводить к возрастанию энтропии. Это природный факт, который приводит к тому, что невозможна самопроизвольная передача тепла от холодного тела к горячему.
Ну и кратко обратимся к теореме Нернста, которую часто называют третьим законом термодинамики и которая тесно связана с энтропией системы. Первоначально эта теорема применялась только к конденсированным системам, но затем ее использование было распространено также и на газы. Сформулируем эту теорему так: энтропия любой системы при абсолютном нуле всегда может быть принята равной нулю. Физически теорема Нернста может быть интерпретирована так: все возможные состояния системы при температуре Т=0 имеют одинаковую энтропию.
Выше говорилось, что теорема Нернста объясняется только квантовой механикой. Почему? На пальцах объяснить это тоже довольно сложно, опять же из-за обилия формул и специальных терминов, которые простому обывателю непонятны...но для тех, кому интересно, отмечаю, что в рамках данной теоремы термодинамическому состоянию системы соответствует огромное число динамических состояний и в результате в определении энтропии участвует величина, называемая вероятностью состояния, которая как раз и представляет собой число динамических состояний. Эта величина вводит некоторую неопределенность и произвольность в определение энтропии. Это может быть устранено только при использовании принципов квантовой теории, которая вводит прерывность в определение динамического состояния системы (дискретные квантовые состояния). И в результате всех выкладок получается, что термодинамическому состоянию системы при абсолютном нуле соответствует только одно динамическое состояние, а именно: динамическое состояние с наименьшей энергией, совместимое с данным агрегатным состоянием системы. Именно это и устанавливает теорема Нернста в квантовой интерпретации. Это как раз и показывает, что теорема Нернста не может быть ошибочной, потому что не может быть несколько динамических состояний с наименьшей энергией.
В заключение скажу, что здесь я лишь в общих чертах, эскизно, базисно, обратился к законам термодинамики. На самом деле это очень обширная область с обильным количеством математики и экспериментов. Но тем не менее мы с вами каждый день следуем этим законам. Согласно законам термодинамики буйные атомы горячего чая безжалостно бомбардируют атомы нашего более холодного языка, передавая им свою энергию, поэтому мы обжигаем язык. Если мы оставим чай на столе, он непременно будет остывать. Если мы отключим холодильник от розетки, он перестанет охлаждать продукты. Если в водо-водяных ядерных реакторах мы не будем с помощью насосов подавать теплоноситель (воду) в активную зону реактора, самопроизвольно это не произойдет и мы не сможем обеспечить постоянную выработку пара для турбины и соответственно выработку электроэнергии.