Эволюция в действии: патогены
Патогенные микроорганизмы, угрожающие здоровью человека, постоянно развиваются, чтобы преодолеть нашу иммунную защиту. Но теперь мы можем отслеживать эти изменения, даже если они происходят на генетическом уровне.
Одной из главных движущих сил эволюции является естественный отбор, когда отдельные организмы с определенным генетическим составом производят больше потомства, чем другие в этой же среде. Это приводит к адаптациям и изменениям таких организмов, позволяющим им выживать, тогда как другие погибают.
Иллюстрация вируса Эбола, показывающая молекулы поверхностного белка, которые помогают вирусу проникать в клетки. Источник изображения: Science Photo Library / De Angelis, Maurizio
Как установил Дарвин, процесс естественного отбора, в результате которого черты, повышающие «приспособленность» организма, становятся доминирующими в популяции, способствует разнообразию, которое мы наблюдаем у живых видов. Но это также является и фактором в процессах, которые угрожают нашему выживанию, таких как распространение вирусных инфекций и появление устойчивости к антибиотикам у бактериальных патогенов.
В этой статье мы сфокусируемся на одном замечательном исследовании, в котором подробно рассматривается, насколько быстро эволюционируют патогены, угрожающие нашему здоровью.
Эксперимент Майкла Байма. Устойчивость к антибиотикам
Примером эволюции положительного естественного отбора в учебниках является появление устойчивости к антибиотикам у бактерий. Применение антибиотиков оказывает избирательное воздействие на популяцию бактерий, которые очень быстро мутируют и размножаются. В результате любые генетические варианты, которые защищают бактерии от антибиотика, остаются в популяции, а все другие варианты исчезают. Этот процесс был зафиксирован на камеру доктором Майклом Баймом (просмотреть видео можно в конце статьи), исследователем из Гарвардского университета в США.
В 2015 году Байм создал хитроумное устройство для визуализации распространения устойчивых бактерий в среде с антибиотиками. Он использовал гигантскую прямоугольную чашку Петри шириной 60 см и длиной 120 см (стандартная чашка Петри диаметром 9 см), заполненную агаром, желеобразной субстанцией для выращивания бактерий, окрашенной в черный цвет. Важно отметить, что он добавлял в агар антибиотик, концентрация которого постепенно увеличивалась по длине чашки (рис. 1), от нулевого содержания антибиотика на краях чашки до 1000 единиц антибиотика в центральных срезах - этого должно быть достаточно, чтобы убить любые бактерии.
Байм установил прожектор и камеру над чашкой так, что чтобы любые колонии бактерий были четко видны в виде белых пятен на фоне черного агара. Затем он поселил бактерии Escherichia coli ( E. coli , Кишечная палочка) на краях чашки, где не было антибиотиков и стал наблюдать за процессом размножения (рисунок 2).
Рисунок 1: Вверху: гигантская чашка Петри, используемая Баймом и его коллегами. Снизу: различные области блюда с концентрациями антибиотиков, увеличивающимися в 10 раз на каждом этапе. Источник изображения: Лаборатория Кишони, Гарвардская медицинская школа и Израильский технологический институт
Что же произошло дальше?
Кишечная палочка может перемещаться в пределах верхнего слоя агара, поэтому, когда бактерии заполнили всю первоначальную область на поверхности агара без антибиотика, они стали перемещаться в другой регион (рисунок 3). Однако их размножение было остановлено антибиотиком в соседней области так, что только бактерии с мутациями, позволяющими им выжить при этом воздействии, могли распространяться дальше. Таким образом, первая область, содержащая антибиотик (в концентрации всего одной единицы), была первоначально захвачена одиночными мутировавшими бактериями. Они размножались и их потомство распространялось по всей области, пока они сами не достигли следующей, с более высокой концентрацией антибиотика. На границе бактерии снова останавливались, пока не появлялись новые мутации, обеспечивающие повышенную толерантность к антибиотику.
Этот процесс повторялся на каждой границе до тех пор, пока после 11 дней бактерии E. coli не покрыли всю поверхность гигантской чашки, при этом бактерии в центре чашки развивали устойчивость к концентрациям антибиотиков в 1000 раз выше, чем у края (рисунок 4). Каждый шаг в этом процессе был запечатлен на известном ныне видео .
Рисунок 2: Чаша Петри с бактериями с недавно добавленными бактериями на каждом конце. Источник изображения: Лаборатория Кишони, Гарвардская медицинская школа и Израильский технологический институт
Рисунок 3: Появление первой популяции бактерий (отмечено стрелкой), способной выживать при низкой концентрации антибиотика. Источник изображения: Лаборатория Кишони, Гарвардская медицинская школа и Израильский технологический институт
Рисунок 4: Бактериальный рост через 11 дней. Бактерии в центре устойчивы к дозировке антибиотика в 1000 раз выше, чем на рисунке 3. Источник изображения: Лаборатория Кишони, Гарвардская медицинская школа и Израильский технологический институт
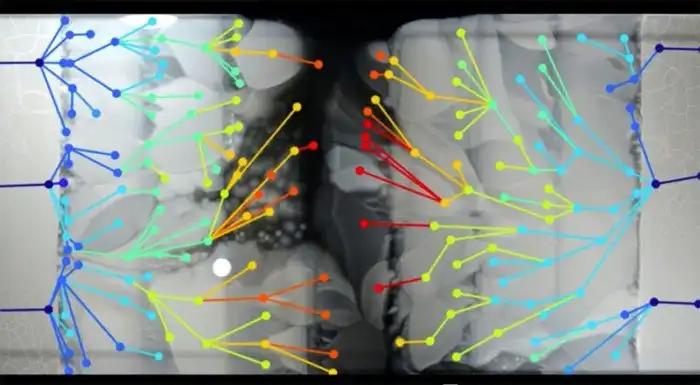
Поскольку исследователи могли видеть распространение бактерий по кадрам, они также могли отобрать бактерии в критических точках, где возникли конкретные мутации. Секвенируя эти геномы, они смогли точно определить изменения на каждом этапе эволюции их устойчивости (рис. 5).
Оказалось, что многие из мутаций происходили несколько раз, поэтому кажется, что некоторые пути к сопротивлению встречаются чаще, чем другие. Кроме того, произошли некоторые мутации в генах, которые, по-видимому, не имели никакого отношения к антибиотику, что иллюстрирует важный момент в развитии резистентности: необходимость адаптации к антибиотику является бременем для основных метаболических процессов, поэтому в отсутствие антибиотиков устойчивые бактерии часто растут медленнее, чем не устойчивые.
Дополнительные мутации были необходимы для компенсации метаболического бремени, и это может быть еще одной причиной паузы роста на границах, где концентрация антибиотика увеличилась.
Рисунок 5: Бактериальные мутации, визуализируемые как «родословные», установленные путем секвенирования ДНК колоний из разных областей чаши Петри. Источник изображения: Лаборатория Кишони, Гарвардская медицинская школа и Израильский технологический институт
На следующем этапе этого эксперимента Байм и его коллеги сделали еще одно важное наблюдение. Если бы они создали разницу между концентрациями антибиотиков в соседних областях намного больше, никакие мутанты не смогли бы выжить в следующей области, и рост бактерий полностью прекращался бы на первой же границе. Это явление можно объяснить тем же принципом: когда воздействие антибиотиков в окружающей среде действительно высоко, бактерии практически не могут размножаться, потому что механизмы, необходимые для преодоления такого бремени, требуют слишком большого количества мутаций одновременно, из-за этого бактерии умирают.
Эволюция бактерий на гигантской чашке Петри