Благодаря аммиаку удается прокормить миллиарды людей. Как получать его, не нанося ущерб планете?
Не так давно количество людей на планете Земля перевалило за восемь миллиардов. Несмотря на все эпидемии и войны. Не в последнюю очередь благодарить за это нужно аммиак, позволяющий накормить всю эту ораву. Он входит в состав многих удобрений, и сельхозпредприятия всего мира используют около 144 миллионов тонн этого неорганического вещества в год. Его производство губительно воздействует на климат планеты, но ученые ищут способ сделать этот процесс более экологичным.
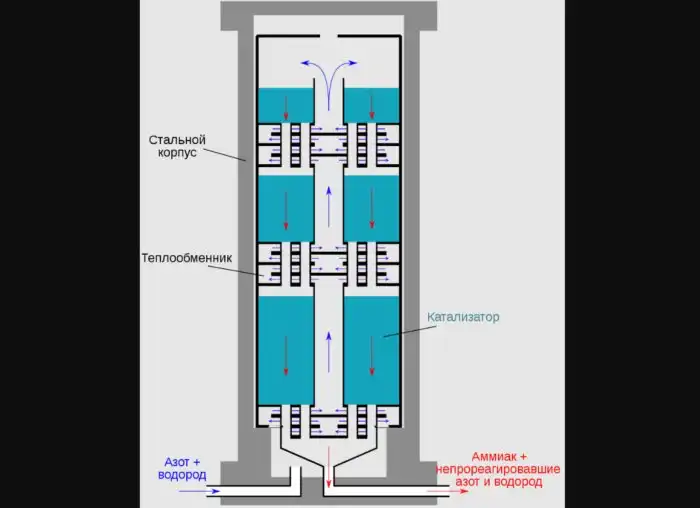
В течение прошедшего столетия человечество использовало для изготовления аммиака процесс Габера-Боша: Молекула аммиака состоит из атома азота и трех атомов водорода, и в данном случае она образуется путем объединения необходимых компонентов под воздействием высокой температуры (450-650°C) и приличного давления (200-400 атмосфер). Понятно, что это требует огромного расхода энергии, которая в наши дни добывается преимущественно за счет сжигания ископаемого топлива. Но этим все не ограничивается.
Азот можно получать где угодно, в том числе из атмосферы, где его около 80%. Водород же в основном добывается за счет расщепления метана, внутри молекулы которого находится увесистый атом углерода, связывающийся после реакции с кислородом и образующий углекислый газ. Подчитано, что при производстве аммиака сегодня выбрасывается более 1% CO2 в атмосферу. Может показаться, что это не так уж и много, однако на самом деле речь идет примерно о 400 миллионах тонн в год.
Схема колонны синтеза аммиака
Население Земли продолжает расти, а это значит, что для его прокорма требуется ещё большее количество аммиака. Поэтому было бы уместно полностью отказаться от процесса Габера-Боша и придумать что-то более безопасное для климата. Одним из самых перспективных шагов в этом направлении считается освоение реакции электрохимического восстановления азота (ENRR). Она может проистекать при комнатной температуре и обычном давлении, то есть не требует огромного расхода энергии.
В чём суть процесса
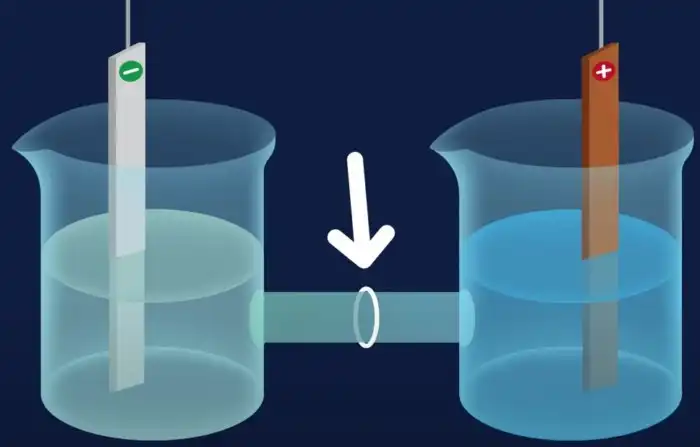
Установка, в которой все происходит, напоминает аккумулятор, но работает в «обратном направлении».
Внутри находится контейнер, наполненный электролитом – жидкостью, проводящей электрический ток, в которой растворены кислота, щелочь или соли. В электролит по разные стороны от мембраны, через которую могут проходить протоны (ядра водорода), помещаются два электрода.
Каждый из электродов покрыт катализатором, усиливающим химические реакции при подаче в систему тока. ENRR также подразумевает получение аммиака посредством соединения водорода с азотом, но первый из химических элементов берется не из метана, а из обычной воды.
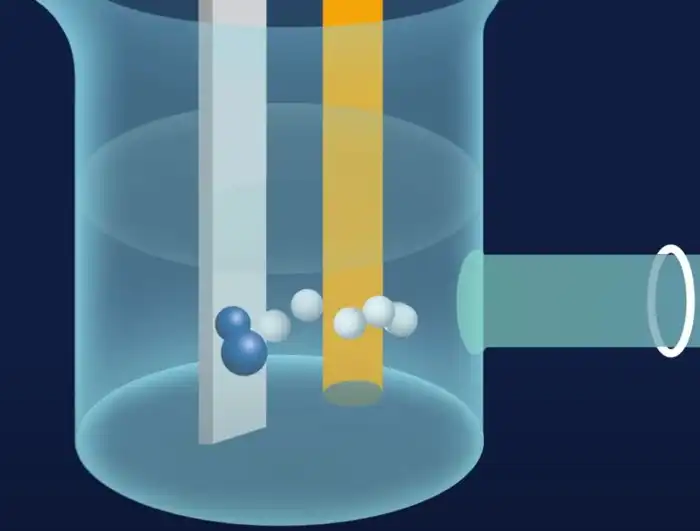
В первом отделении установки молекулы воды в растворе электролита вступают в реакцию с катализатором, в результате чего расщепляются на ядра водорода, свободные электроны и кислород. Электрический ток переправляет водород через мембрану, а электроны попадают во вторую половину.
В электролит, находящийся там, подается азот. Вступая в реакцию с местным катализатором, молекулы газа распадаются на атомы, которые затем соединяются с прошедшим через мембрану водородом и образуют в результате аммиак.
К сожалению, эту радужную картину портит проблема с электролитами. Те, что имеют водную основу, чрезвычайно неэффективны при получении аммиака, так как молекулы H2O склонны похищать электроны для каких-то собственных целей. Альтернативой могут стать густые, вяжущие субстанции, в которых ионы водорода замедляются во время перемещения от одного электрода к другому, но их ещё только предстоит найти.
И что в итоге мы имеем?
В общем и целом, на настоящий момент времени сложилась следующая ситуация: доказано, что реакция электрохимического восстановления азота способна генерировать аммиак, но уменьшить зависимость человечества от процесса Габера-Боша наука пока не может. Такая вот загогулина получается.
Ученые, естественно, прилагают все необходимые усилия, чтобы найти решение. Они экспериментируют и с электролитами, и с катализаторами. Если у них получится добиться желаемого, человечество сможет кормить себя вдоволь, не ухудшая попутно климат планеты. Кроме того, аммиак мог бы стать неплохим топливом. Это довольно энергоемкое соединение, которое совсем неспроста используется злыми террористами для изготовления взрывчатых веществ.
Литр аммиака выделяет столько же энергии, сколько, к примеру, триста грамм бензина, но не дает в качестве побочного продукта углекислый газ. При этом надо осознавать, что данное соединение несет угрозу для людей, животных и природы в целом. Это загрязнитель, способный отравить почву и водные источники. Как видим, в этом направлении есть ещё над чем поработать, однако хочется верить, что технология все же будет освоена. Уж очень перспективно она выглядит.